时间:2024-02-21作者:审稿:宋三多 来源:动物医学院
疱疹病毒劫持宿主转录机器转录病毒基因已成共识,但不同疱疹病毒劫持宿主转录机器的机制存在明显差异。作为大多数细胞基因通用的正性转录因子,P-TEFb在病毒生物学中发挥着关键作用。研究表明,逆转录病毒、流感病毒和许多DNA病毒都需要调节P-TEFb活性来劫持宿主转录机器。在疱疹病毒中,单纯疱疹病毒1型(HSV-1)的ICP22和VP16蛋白、卡波西肉瘤相关疱疹病毒(KHSV)的K-cyclin蛋白和EB病毒(EBV)的EBNA2已被发现可调节P-TEFb活性。HEXIM1作为P-TEFb的关键负调控因子,在P-TEFb募集和解离的平衡中发挥关键作用,其表达异常或自身调节功能改变可能导致P-TEFb功能失调进而影响基因的转录延伸环节。
2024年02月16日,国家现代农业产业(水禽)体系免疫抑制病防控岗位专家、四川农业大学动物医学院动物医学免疫学研究所程安春教授团队在JVI上发表了题为“An alpha-herpesvirus employs host HEXIM1 to promote viral transcription”的原创性研究成果。该研究探究了宿主HEXIM1在鸭疱疹病毒1型(鸭瘟病毒)转录中的作用机制,对深入了解α-疱疹病毒劫持宿主转录机器转录病毒基因机制有重要意义。

团队在使用基因集富集分析(GSEA)分析鸭瘟病毒感染鸭胚成纤维细胞(DEFs)前后的RNA-seq数据时,发现一个与RNA聚合酶II(RNAPII)和DNA模板转录介导的转录负调控相关的宿主基因HEXIM1,在鸭瘟病毒感染后高表达。RNA-seq丰度、qPCR和Western Blotting实验均表明鸭瘟病毒感染显著增加了DEFs中HEXIM1的表达。此外,团队还检测了鸭瘟病毒感染期间HEXIM1在体内的表达。结果发现HEXIM1在鸭体内的表达受鸭瘟病毒的时空调控,并与鸭瘟病毒感染鸭的引起的疾病进程相关,这表明宿主的HEXIM1不仅仅是参与鸭瘟病毒的转录,也在鸭瘟病毒感染鸭的发病机制中发挥作用(图1)。
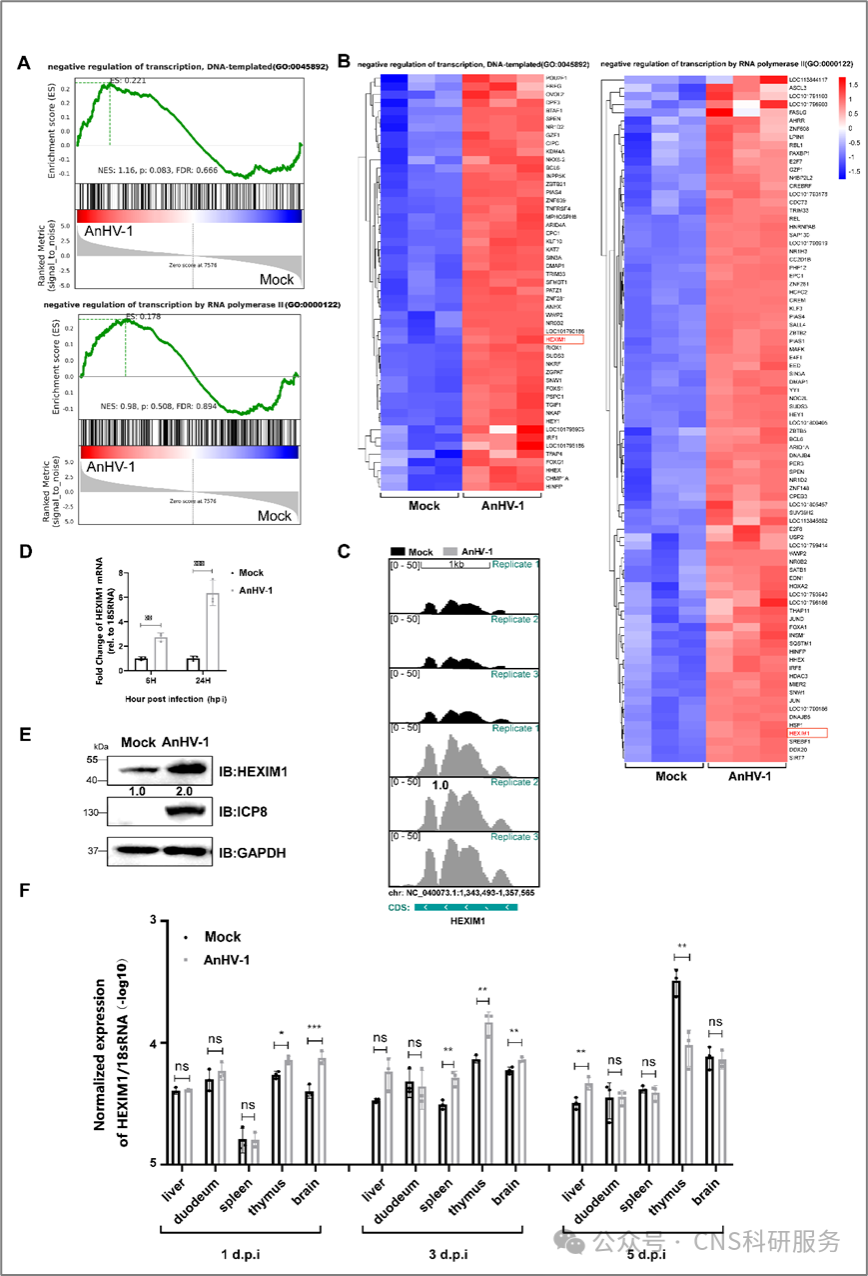
图1.鸭瘟病毒感染DEF细胞和感染鸭均可调控HEXIM1的表达
为了进一步探究HEXIM1与鸭瘟病毒之间的关系,作者对HEXIM1进行了序列比对,发现HEXIM1在物种间具有高度保守性,特别是与CDK9相互作用的功能域。Western Blotting实验中发现,HEXIM1表达与鸭瘟病毒感染剂量和时间呈正相关,而CDK9磷酸化(pCDK9)和RNAPII Ser2磷酸化(RNAPII S2P)水平则与鸭瘟病毒感染剂量和时间呈负相关。免疫共沉淀实验表明,鸭瘟病毒诱导的HEXIM1的高表达促进了HEXIM1- CDK9复合物的形成。这可能是鸭瘟病毒感染导致宿主CDK9和RNAPII S2磷酸化丢失的原因之一(图2)。
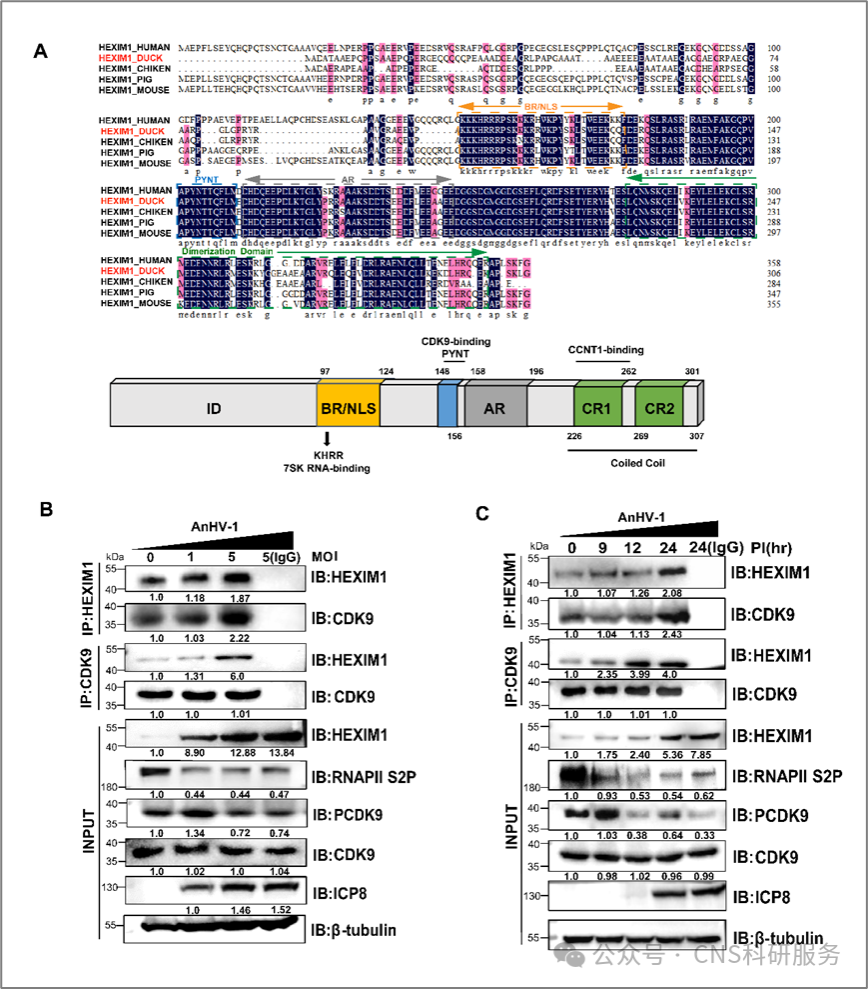
图2.鸭瘟病毒感染以时间和剂量依赖方式增强了HEXIM1和CDK9之间的相互作用
随后的研究发现,siRNA敲低HEXIM1抑制鸭瘟病毒的体外增殖;而无论是转染质粒还是HMBA处理诱导HEXIM1过表达,均得到了与敲低HEXIM1完全相反的结果,表明HEXIM1高表达能够促进鸭瘟病毒的感染(图片未展示)。
病毒转录和DNA复制发生在不同的核结构域,称为病毒复制区室(VRCs)。因此,在鸭瘟病毒感染过程中,追踪VRCs的形成以及RNAPII的位置将有助于解释HEXIM1如何影响病毒转录。如图3所示,鸭瘟病毒感染后,原本弥散分布在细胞核内的RNAPII S2P在细胞核中聚集成点状分布,并与病毒转录因子ICP4共定位。通过统计分析鸭瘟病毒感染后VRCs的形成和RNAPII S2P的募集,作者发现HEXIM1促进了VRCs的形成以及ICP4和RNAPII S2P的共定位(图3),表明在宿主RNAPII S2P有限的情况下,鸭瘟病毒仍然能够优先招募RNAPII S2P至VRCs。
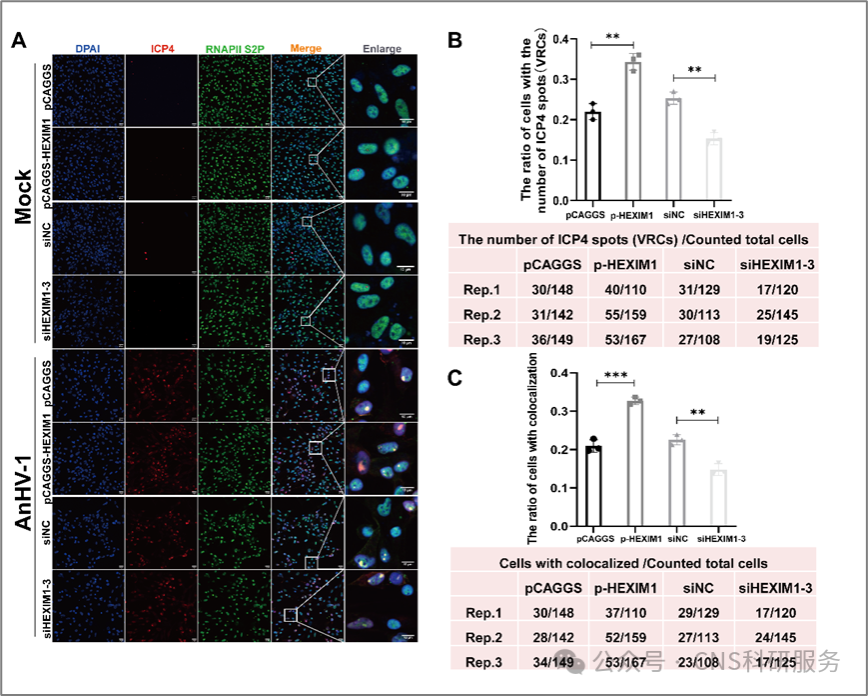
图3. HEXIM1促进RNAPII S2P向ICP4位点募集
为了从全局角度更好地表征RNAPII S2P在病毒和宿主基因组上的结合情况,作者进行了CUT&Tag和RNA-Seq联合分析。观察结果显示,鸭瘟病毒感染引起RNAPII的重新分布,将RNAPII大量劫持至病毒基因组,而许多与细胞增殖相关宿主基因的RNAPII结合率则显著下降。随后的挽救实验发现,在鸭瘟病毒感染条件下,CDK1、ID2、MYC和SOX8与RNAPII S2P的结合降低可通过敲低HEXIM1得以挽救,而代表性病毒基因上的RNAPII S2P富集则显著受损(图4)。表明尽管鸭瘟病毒感染后宿主RNAPII S2P水平显著降低,但鸭瘟病毒仍然可以有效地劫持宿主RNAPII进行病毒基因的转录延伸,该机制与HEXIM1高度相关。
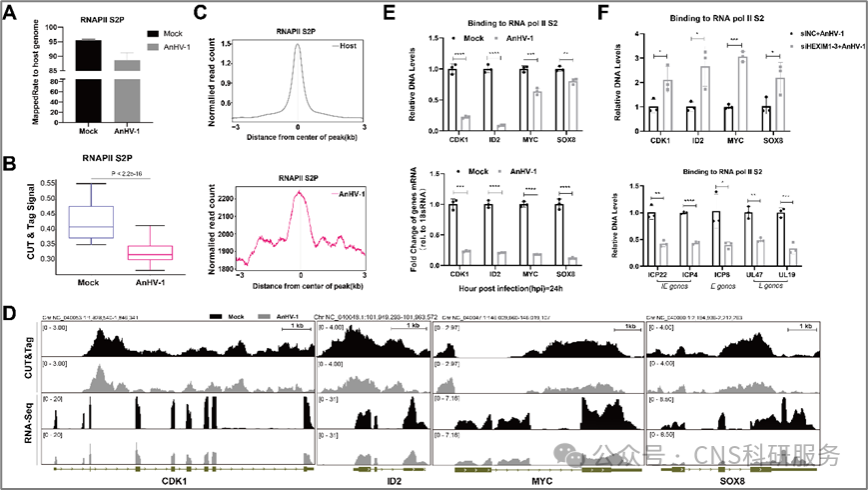
图4. HEXIM1帮助鸭瘟病毒劫持RNAPII,但抑制其与宿主基因的结合
最后,作者发现鸭瘟病毒中的US1基因通过其C端显著促进HEXIM1 mRNA的合成。然而,与其在HSV-1中的同源物不同,HEXIM1或CDK9与鸭瘟病毒的US1基因之间不存在相互作用。序列比对发现HSV-1-US1中与CDK9互作的195-256AA结构域与AnHV-1 US1全长序列比对结果并不保守(图片未展示)。表明HSV-1 US1和AnHV-1 US1降低RNAPII S2磷酸化水平的机制存在差异。
本研究所揭示的HEXIM1依赖的鸭瘟病毒转录调控机制可能是许多DNA病毒所表现出的宿主关闭的一个以前未被认识的方面。其他疱疹病毒是否以类似的方式操纵HEXIM1,以及是否可以利用这一分子靶点来限制病毒的高效复制,也将是一项有趣的研究。
国家现代农业产业(水禽)体系免疫抑制病防控岗位专家、四川农业大学动物医学院动物医学免疫学研究所程安春教授为本论文通讯作者,四川农业大学动物医学院动物医学免疫学研究所吴英副教授和博士研究生孙安阳为该论文的第一作者。
原文链接:https://pubmed.ncbi.nlm.nih.gov/38363111/
科学网报道链接:https://news.sciencenet.cn/htmlnews/2024/2/517908.shtm

















